在急性肝损伤的早期阶段,肝细胞如何在“修复”与“生存”之间作出抉择?云南大学生命科学学院单昭团队和彭城团队在 eLife 发表的最新研究给出了答案——肝脏中部区域(mid-zone)的肝细胞会主动暂停增殖,以换取存活机会。这一保护性机制由 Atf4–Chop 信号轴 驱动,通过诱导细胞周期抑制因子 Btg2,暂时关闭细胞增殖程序,从而帮助肝细胞抵御毒性打击。

Ø 受损肝区的“紧急刹车”
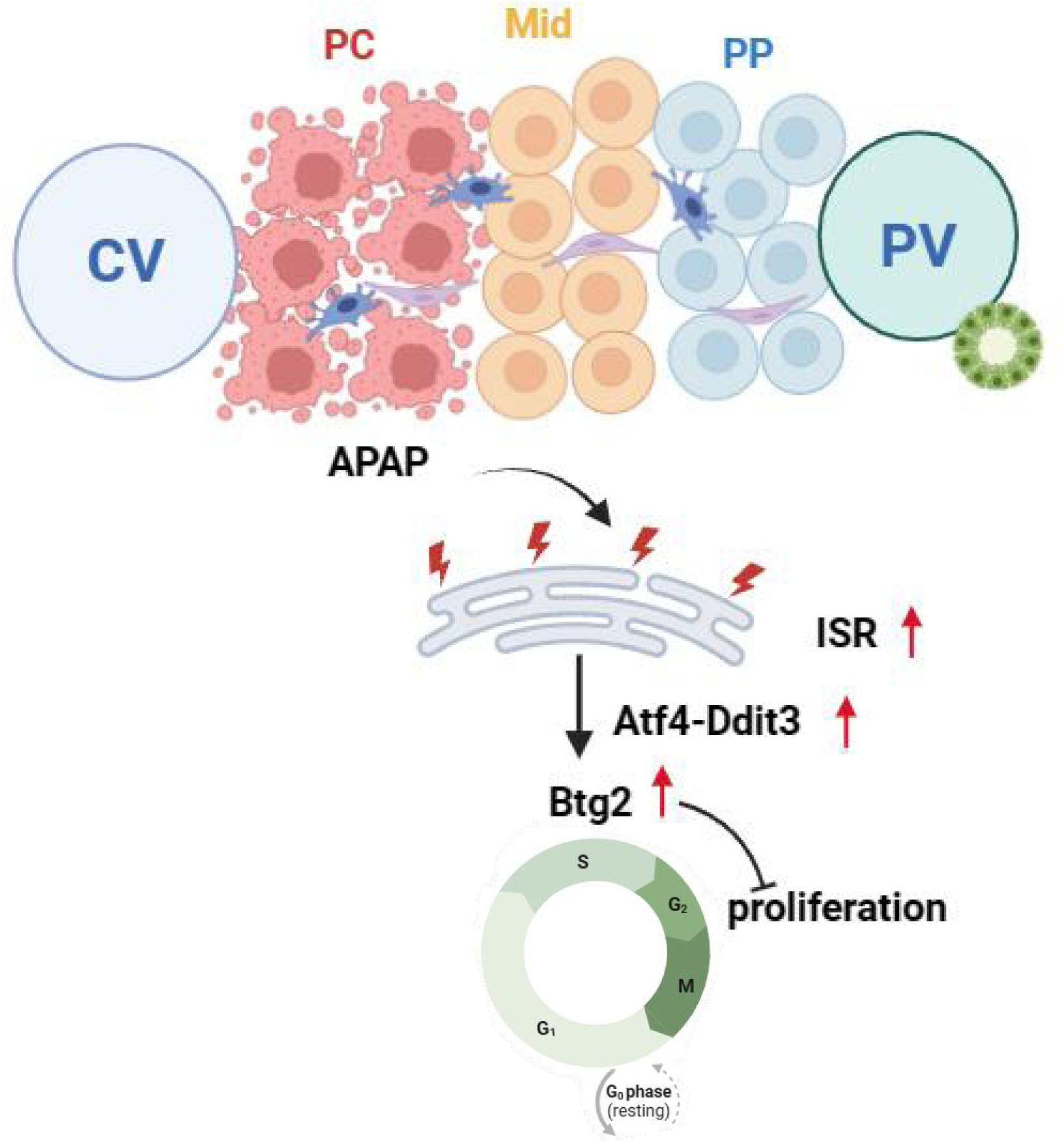
研究团队使用对乙酰氨基酚(acetaminophen, APAP)诱导小鼠急性肝损伤模型,并结合空间转录组学、免疫染色与功能实验,发现肝细胞在受损早期出现显著的增殖下降,以肝小叶中部区最为显著。与肝小叶的其他区域相比,中部肝细胞的Ki67阳性比例骤降近三倍,但在24小时后又逐渐恢复。这表明中部区细胞在毒性应激最强时选择“刹车”——暂缓再生,以集中资源求得生存。
Ø Atf4–Chop 信号轴:细胞的“生存开关”
进一步的空间转录组分析揭示,这种暂时的“静止”状态并非被动停滞,而是由一套主动的应激响应程序控制。研究团队发现,Atf4–Chop(Ddit3)信号轴在中部肝细胞中被强烈激活。该通路属于整合性应激反应(Integrated Stress Response, ISR)的一部分,能在能量受限或蛋白折叠压力下重编程细胞的基因表达,使其优先保障生存。
在此过程中,下游基因 Btg2 被显著上调。Btg2作为细胞周期抑制因子,可阻断G2/M期进程,从而暂时停止细胞分裂。研究人员通过AAV介导的基因过表达和敲降实验进一步证实,上调Btg2能减轻肝损伤但抑制细胞增殖;相反,敲低Btg2则促进增殖但加重肝损害。这说明在急性损伤的早期,停止增殖反而是一种“理智”的自救策略。
Ø “先活下来,再修复”——肝细胞的智慧应答
这一发现揭示了肝脏在急性毒性损伤中的动态平衡机制:中部肝细胞通过Atf4–Chop–Btg2通路暂停增殖,优先修复自身,从而保留未来再生的潜能(模式图)。研究指出,这种“生存优先、再生随后”的策略,有助于解释肝脏在再生与保护之间的精准调控。

云南大学生命科学学院博士研究生祝雅莹(单昭组)为该论文第一作者,邓成翔(彭城组)、陈泊(单昭组)、何佳(单昭组)作为共同第一作者,研究生刘雅楠也参与该研究工作。单昭、彭城为本论文的通讯作者。
致谢:感谢祁斌研究员(云南大学)的建议与讨论;感谢韦永龙教授(云南大学)对空间分布量化的帮助;感谢殷昊教授(武汉大学)提供pHelper和pAAV2/8质粒;感谢Shalev Itzkovitz教授(魏茨曼科学研究所)提供smFISH 实验方法;感谢杨辉教授(中科院神经科学研究所)提供CasRx系统相关质粒。本研究得到国家自然基金面上项目,云南省科技厅项目,云南省基础研究项目等经费资助。
原文链接:https://doi.org/10.7554/eLife.108646.1
