线粒体是物质代谢中心和信号级联平台,是执行和协调细胞内各种生物学过程的重要细胞器,包括ATP合成、钙稳态和脂质代谢。线粒体的结构特征在于嵴,其形成和维持依赖于线粒体蛋白质的正确翻译和定位。线粒体结构和功能正常是维持线粒体稳态的基础,线粒体功能障碍会导致严重的神经和发育性疾病。
经典观点认为,线粒体蛋白是在细胞质中完成翻译和组装之后再运输和靶向到线粒体发挥功能。但近年,线粒体定位mRNA、核糖体及局部翻译现象的结果表明线粒体翻译和靶向可能同时存在;加州理工学院最新的两项研究显示,约20%的线粒体蛋白质在翻译的过程中就利用N端前导序列开始了靶向线粒体的转运,开启“共翻译输入”模式。然而,线粒体定位翻译如何被组织缺乏直接证据,特别是共翻译输入在线粒体结构和功能维持中的作用目前尚不清楚。此外,线粒体定位翻译在线粒体嵴结构的形成和维持中的必要性尚未明确,在胁迫和衰老过程中的生理作用仍有待探究。
2025年9月10日,云南大学生命科学研究中心杨崇林研究团队,在自然衰老期刊Nature aging 上发表了题为: Mitochondria-associated condensates maintain mitochondrial homeostasis and promote lifespan 的研究成果。该研究直接揭示线粒体上的蛋白凝聚体作为蛋白质翻译的场所“码头(mitochondria-associated translation organelles, MATOs )”, 原位合成线粒体蛋白,“码头”与TOM 复合物互作,共翻译转运进入线粒体,维持其结构和功能。在胁迫和衰老条件下,“码头”会解聚,线粒体结构和功能随之破坏。反之,锚定在线粒体上的“码头”可以维持胁迫或衰老过程中的线粒体健康,延长机体寿命。

在该研究中,研究者首先利用以秀丽线虫为模式的线粒体稳态研究系统,通过正向遗传学筛选和基因克隆技术,发现RNA 结合蛋白(RBP)LARP-1 的功能缺失会导致线粒体形态呈球状异常。与此一致, larp-1 突变体中的线粒体内嵴结构存在缺陷,与 MICOS 复合物和呼吸链复合物的突变体相似,而这些复合物是线粒体嵴结构形成的关键因素。线粒体功能分析结果显示,LARP-1功能缺陷导致呼吸耗氧率(OCR)降低、ATP 生成减少以及摆动频率降低等线粒体功能损伤。larp-1 突变体表现后代数目减少、胚胎致死、幼虫发育迟缓和寿命缩短等严重缺陷。上述结果表明,LARP-1对维持线粒体形态、结构和功能的完整性,以及线虫正常的生理功能非常重要。
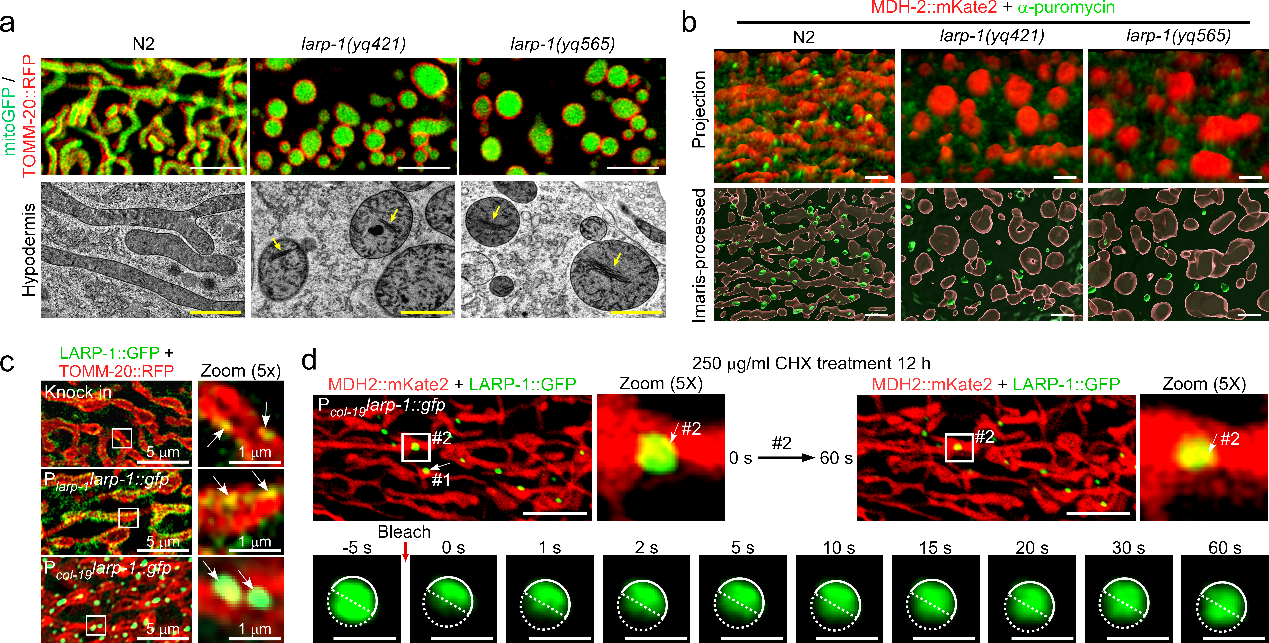
图1. larp-1突变体,成虫表皮细胞线粒体呈球状异常结构,并伴随嵴结构破坏(a);LARP-1 依赖性的蛋白质合成发生在线粒体表面(b);LARP-1在体内,以浓度依赖的方式驱动液-液相分离(LLPS)(c),在线粒体上形成具有内部流动性的凝聚体(d)。
进一步探究LARP-1调控线粒体结构和功能的作用机制。研究者发现在 larp-1 突变体中,约 84%线粒体蛋白质表达水平降低,增强 IMMT-1/Mic60 的表达在很大程度上挽救larp-1 突变体中的线粒体缺陷。通过APEX2临近标记技术,鉴定出了与LARP-1直接互作的mRNAs和蛋白质。此外,他们观察到LARP-1 依赖性的蛋白质合成确实发生在线粒体表面,且LARP-1与线粒体存在共定位,并且随着局部组织表达浓度的升高在线粒体表面形成点状结构。生物化学和细胞生物学研究结果表明,LARP-1 能够在体内、外,以浓度依赖的方式驱动液-液相分离(LLPS),在线粒体上形成具有内部流动性的凝聚体。LARP-1与翻译机器蛋白和9种RBPs直接相互作用,也都能够被分拣到LARP-1蛋白凝聚体中,且9 种 RBPs的RNAi 使线粒体缺陷类似于 larp-1 的缺失。 这些结果共同表明,RBPs形成“码头”,影响线粒体嵴形成关键蛋白质的翻译调控线粒体稳态。LARP-1 在线粒体表面通过 LLPS协调包含 mRNA、翻译机器蛋白和9种RBPs形成“码头”,影响线粒体嵴形成关键蛋白质的翻译调控线粒体稳态。
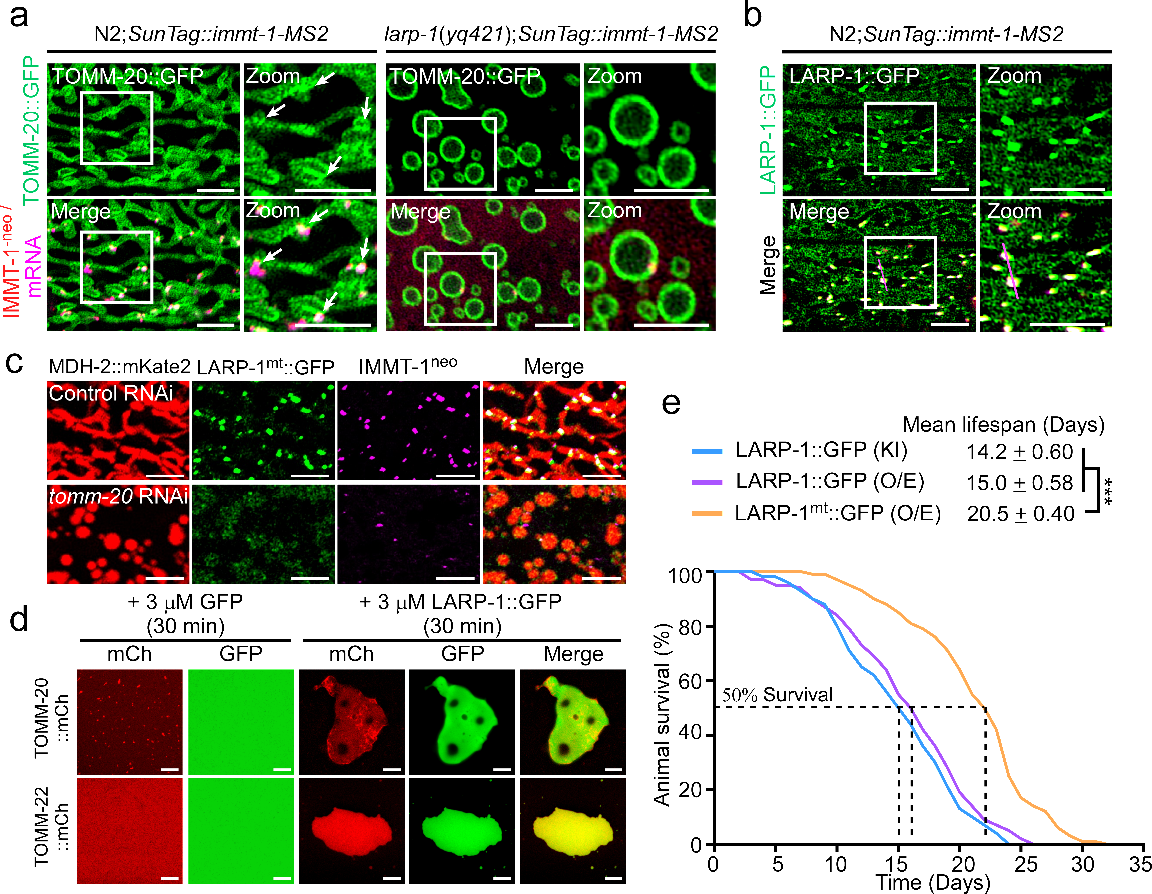
图2. SunTag-scFv和MS2-MCP系统可视化LARP-1介导的IMMT-1/ATP-2局部翻译过程(a);IMMT-1/ATP-2的mRNA和新生多肽与“码头”共定位(b);对TOM 复合物组分的 RNAi 处理显著减少了 “码头”的数量,破坏了线粒体的结构(c);TOM 复合物组分能够被分选至LARP-1 蛋白凝聚体中(d);“码头”锚定在线粒体上时,显著延长线虫的寿命(e)。
随后,研究者继续探究 LARP-1 “码头”调控线粒体嵴形成关键蛋白质的局部合成和输入机制。他们利用SunTag-scFv和MS2-MCP系统可视化LARP-1介导的局部翻译过程,发现线粒体内嵴组分IMMT-1/ATP-2的mRNA和新生多肽与“码头”共定位。当对编码线粒体外膜蛋白的基因进行RNAi 处理,发现对 TOM 复合物组分的 RNAi 处理显著减少了 “码头”的数量,线粒体结构和功能随之破坏。生物化学结果显示,TOM 复合物组分与LARP-1相互作用,且能够被分选至LARP-1 蛋白凝聚体中。上述结果表明,“码头”可能通过与 TOM 复合物共同驱动 LLPS而与线粒体结合,为线粒体嵴形成关键蛋白质共翻译输入提供了一种有效的途径。
综上,LARP-1 能够驱动LLPS协调翻译机器蛋白组件和多种不同功能的RBPs组成“码头”,通过与TOM 复合物相互作用定位于线粒体上,负责线粒体结构和功能蛋白质的共翻译输入,从而维持线粒体稳态。值得关注的是,研究者分析了“码头”在维持衰老和胁迫条件下线粒体稳态的生理意义。在线虫遭遇胁迫和衰老过程中,“码头”发生明显的解聚,并伴随线粒体形态和结构的破坏。当“码头”锚定在线粒体上时,显著保护了线粒体的健康,并极大延长了线虫的寿命。“码头”的发现为线粒体相关无膜细胞器及线粒体蛋白共翻译输入的研究提供了新契机,为进一步揭示衰老和应激条件下的线粒体稳态调控及生理功能奠定了重要基础。
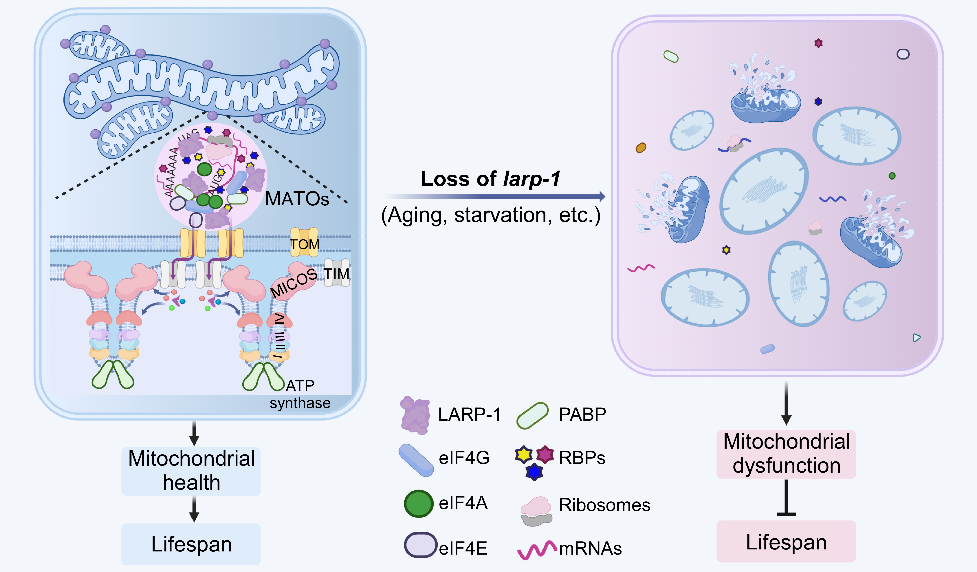
图3. LARP-1 MATOs在正常和应激条件下的组装和解聚工作模型。(Bai et al., Nature aging, 2025)
云南大学生命科学研究中心杨崇林教授为本文通讯作者,白艳博士(现云南大学师资博士后)和马腾飞博士(现昆明医科大学第三附属医院与云南大学联合培养博士后)为共同第一作者。此外,杨崇林组赵珊博士、王鑫老师、杨扬博士、单倩博士、秦子臻同学、刘楠博士、张洁博士和田飞博士,云南大学生命科学研究中心武旭娜(研究员)、李莎兰老师、赖凡(研究员)、李敬阳博士、陈庆锋(研究员)、刘凤莲博士和孙文豪博士也对本研究做出了重要贡献。本项研究受到国家重大研究计划集成项目,国家重点研发计划项目,自然基金委重大项目和云南省科技领军人才项目资助。
原文链接 :https://doi.org/10.1038/s43587-025-00942-x
