肿瘤转移是作为癌症致死的主要诱因,其级联过程涉及局部侵袭、血管内渗、循环系统存活、外渗定植等多个关键环节。尽管相关机制研究已取得显著进展,但针对转移级联反应的精准调控靶点仍待深入解析。
近日,云南大学生命科学学院孙建伟教授团队联合天津肿瘤医院孙燕教授课题组在Science China Life Sciences发表题为“VPS35/Retromer-dependent MT1-MMP regulation confers melanoma metastasis”的重要研究成果,该研究首次揭示了囊泡逆运复合体VPS35/Retromer通过“双模态调控”机制维持膜型基质金属蛋白酶MT1-MMP的稳态,进而驱动黑色素瘤转移。
研究团队通过靶向基因沉默技术筛选证实,Retromer复合体核心组分VPS35的缺失导致MT1-MMP的膜定位异常,使其在核周区异常聚集并加速溶酶体依赖性降解。借助免疫共沉淀(Co-IP)和邻位连接技术(Proximity Ligation Assay, PLA),研究进一步揭示VPS35与MT1-MMP存在直接相互作用,阐明Retromer复合体直接参与MT1-MMP的胞内转运及稳态维持。进一步的研究表明,VPS35/Retromer可激活IL-6/STAT3信号轴,促进MT1-MMP的转录。这种转录调控与蛋白稳定性调控形成协同效应,实现MT1-MMP表达水平的双重保障。
在黑色素瘤肺转移小鼠模型中,VPS35敲降显著抑制黑色素瘤肺转移灶数量,并延长小鼠生存期;而MT1-MMP过表达可完全逆转肿瘤转移,确认MT1-MMP作为Retromer下游核心效应分子。临床组织芯片分析显示,黑色素瘤患者中VPS35与MT1-MMP表达呈显著正相关,进一步说明VPS35与MT1-MMP在肿瘤进展中的协同作用。
该研究首次系统阐明VPS35/Retromer通过“蛋白稳态维持-转录级联激活”的双模态机制调控MT1-MMP的水平,研究同时验证了靶向该信号轴的治疗潜力,为开发基于VPS35/Retromer-MT1-MMP通路的靶向精准抗转移治疗策略奠定了重要理论依据。
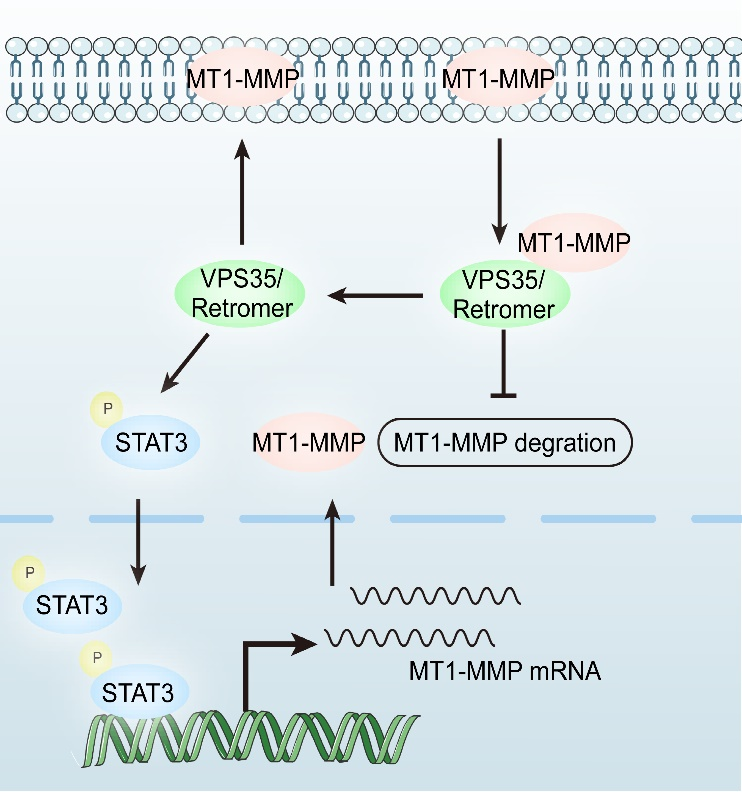
VPS35/Retromer调控MT1-MMP水平模式图
本研究获国家自然科学基金(82273460, 32260167)、云南省科技厅基础研究项目(202401AS070133)、昆明医科大学附属延安医院云南省肿瘤免疫防治研究重点实验室开放课题联合资助。


